研究方向简介
王宝俊教授的研究方向为合成生物学和生物工程,主要包括合成生物学使能技术开发(CRISPR基因编辑与调控、基于内含肽的蛋白组装工具)、基因线路的工程化设计及在生物传感(环境污染、健康检测用便携传感器)、生物计算、生物治疗(肿瘤细菌疗法、人工噬菌体定向清除致病菌)和生物制造(生物功能材料合成、智能细胞工厂设计)等领域的创新应用。近几年,在合成生物学关键使能技术开发、基因线路设计及应用方向取得突破原创性成果,主要包括:(一)国际上率先提出基因线路的工程化设计方法,并开拓了其在超敏感生物传感、活体生物计算等领域的创新应用;(二)国际上率先开发出新型“类真核”原核细菌CRISPR基因激活技术,揭示了II型CRISPR系统crRNA与tracrRNA配对的可编程性机制并开拓了其在RNA生物传感领域的应用;(三)提出了新型分裂蛋白设计定向进化方法和创建了迄今为止规模最大的标准化正交断裂蛋白内含肽文库,解决了高重复结构大分子蛋白的体外精确无缝组装难题。近三年以通讯作者发表重要学术论文20余篇,包括Nature Chemical Biology 等6篇Nature子刊论文。
研究成果介绍
王宝俊教授团队近年来在合成生物学领域的主要创新性学术成果总结如下:
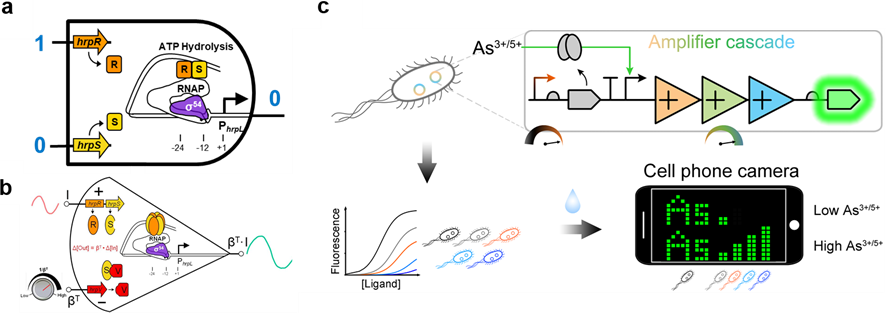
1) 国际上率先提出基因线路的工程化创新设计方法:率先设计并构建了模块化与正交化的基因逻辑门控线路、模块化的转录信号放大线路,建立了基于核酸海绵的新型基因线路全面优化设计方法,拓展了基因线路在生物传感领域的创新应用。并据此开展了与微软、华为公司的技术创新转化合作。
由于生命体系的高维度非线性特性和细胞内生物分子之间无物理绝缘,目前绝大部分设计的基因线路是由少数基因元器件组成的小规模、功能简单的合成生物系统,模块性和正交性低,且往往基于试错法反复尝试后建造的,耗时长、成本高。因此,我们提出基因线路实现规模化设计需遵循模块性(器件输入输出信号模块之间可随意替换和组装)和正交性(包括线路组成元器件间和与细胞底盘部件间相互作用的正交性)的工程化设计原则,且需在标准化工作环境下充分测试基因线路各组成部件特性,以提高生物系统合成组装的功能可预测性(Nature Commun 2011 doi)。
团队利用铜绿假单胞菌中的异源σ54依赖型转录因子和相关基因调控元件在大肠杆菌中率先设计并构建了模块化且正交化的逻辑与门和与非门控线路(Nature Commun 2011 doi;图1a)、模块化且放大倍数连续可调的转录信号放大线路(Nucl Acids Res 2014 doi;图1b)。通过级联多层正交模块化的转录信号放大线路,创建了领域目前最敏感的基于大肠杆菌的砷和汞等重金属污染细胞传感器及创新的可视化输出模块(Nature Chem Biol 2019 doi;图1c)。通过偶联多细胞群体通讯,设计出了多输入逻辑门线路控制的高特异性环境监测细胞传感器(Biosens & Bioelectron 2013 doi)。率先提出和开发了可全面优化合成基因线路设计的核酸海绵多功能基因调控工具,首次展示其能降低因异质蛋白过量表达造成的细胞负荷(Nature Commun 2020, 11:5961 doi)。
2) 国际上率先开发新型“类真核”原核细菌CRISPRa基因激活技术;揭示了II型CRISPR系统crRNA与tracrRNA匹配的可编程性机制,开拓了此项发现在多个生物技术及医学领域的应用。
CRISPR介导的基因激活调控(CRISPRa, CRISPR activation)是一类具有巨大应用潜力的基因调控技术,其独特的可编程性和可扩展性能大幅提高基因激活调控元件的通用性和标准化程度,一直是合成生物学领域备受瞩目的研究对象。尽管CRISPRa在真核细胞中已相当成熟,在原核细胞中,少数搭建的CRISPRa依然受限制于原核基因激活机制的自身特点。如CRISPR激活复合体的靶点范围狭窄,不支持单启动子的多靶点激活;激活输出倍数低,不支持多通道激活和级联调控。
团队率先设计和开发了一种新型“类真核式”CRISPR基因激活调控系统(Nature Commun 2019, 10:3693 doi;图2a)。该系统巧妙利用了细菌σ54因子独特的转录起始“闭锁”机制,将原核细胞CRISPRa的激活输出倍数提高了一个数量级以上,并首次实现了细菌中CRISPR激活的多通道和级联调控。基于此技术,率先提出了“可重复使用”多基因表达谱投影文库的概念,建立了一种新型多基因代谢通路表达谱的筛选平台。不同的多基因表达线路,只需按照标准化的设计原则进行设计,只需构建一个单一质粒,从而极大降低细菌多基因表达通路的优化成本,具有广阔的应用前景。相关技术已申请国际专利(PCT/GB2020/052031)。
基于上述进展,我们系统揭示了II型CRISPR系统crRNA与tracrRNA匹配的可编程性机制,并利用重编程tracrRNAs展示了其在生物计算与生物传感领域多个强大应用案例(Nature Commun 2022 doi;图2b):包括首次揭示重编程tracrRNA-crRNA对的设计原则和正交性,开发双gRNA介导的CRISPR激活(CRISPRa)系统,可编程AND-gate布尔逻辑门装置,劫持细菌内源性环境响应基因转录本(含sRNA和mRNA)探测环境污染物,发明了高特异性SARS-CoV-2病毒RNA传感器AGATHA。

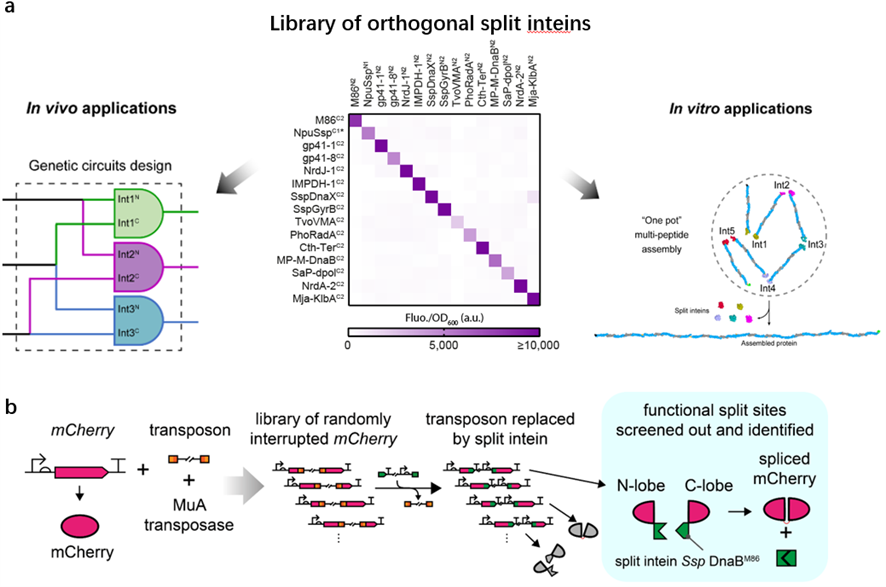
3) 国际上率先提出了新型分裂蛋白设计定向进化方法和开发了领域迄今规模最大的标准化正交断裂蛋白内含肽文库,解决了高重复结构大分子蛋白的体外精确无缝组装难题。
团队首次建立了一个基于断裂红色荧光蛋白的细胞内、外通用的高通量内含肽(intein)筛选及活性断裂位点测试平台,筛选出15对高度正交的断裂内含肽(split intein)元件,构建出迄今为止最大规模的正交断裂内含肽元件库(Nature Commun 2020,11:1529 doi;图3a)。利用这一内含肽文库,实现了高重复结构大分子蛋白的体外精确无缝组装,解决了高重复结构大分子蛋白长期以来难以在异源表达系统中合成的基因工程难题。
基于上述成果,我们率先将内含肽与转座子工具结合开发了一种新型分裂蛋白设计定向进化方法IBM (intein-assisted bisection mapping,Nature Commun 2021 doi;图3b),从而能简便地扫描和筛选合适的蛋白质分裂功能位点;并据此设计出了多种蛋白表达逻辑控制器件和显著降低蛋白本底表达水平的调控工具。这一新成果为包括合成生物学的基因工程、蛋白质工程学提供了在蛋白质水平上进行生物分子组装、编辑和调控的强力工具,有望在工业、医疗领域展现出广阔应用前景。